Fémek
Nemfémek
Félfémek
A kémiai elemek kémiailag tovább már nem bontható, egyszerű anyagok (kémiai úton nem bonthatók tovább többféle, kémiailag tiszta anyagra).Atommagjukban azonos számú protont tartalmaznak, tehát azonos rendszámú atomfajtákból felépülő tiszta kémiai anyagok. Példák elemekre : szén, arany, oxigén. Jelenleg 117 különböző kémiai elemet ismerünk. Ezek közül a Földön 92 található meg a természetben. Ezek az ún. természetes kémiai elemek. A többit mesterséges úton állították elő. Ezek az ún. mesterséges kémiai elemek. Az elemek száma, a hipotetikus radioaktív elemekkel együtt, jelentősen nagyobb lehet, bár az atommag és a külső elektronhéjak stabilitása ennek felső határt szabhat.
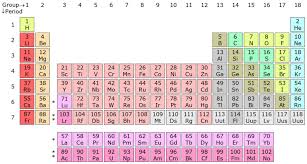
A kémiai elemek a periódusos rendszerben vannak rendszerezve.
Az azonos protonszámú, de különböző neutronszámú atomok az izotópok. A protonszám és a neutronszám összege adja az izotóp tömegszámát. A legtöbb kémiai elem izotópok elegye, ezeket "keverékelemek"-nek nevezzük. Például a hidrogénnek három izotópja van: a könnyű-hidrogén (Prócium): 1H, a nehéz-hidrogén (Deutérium): 2H, és a radioaktív , szupernehéz-hidrogén (Trícium): 3H.
A kémiai elemek fontos jellemzői a vegyérték, elektronegativitás, elektronkonfiguráció, elektronaffinitás, ionizációs energia, atomtömeg...
Kémiai jellemük alapján a kémiai elemek feloszthatók nemfémekre (17), félfémekre (8) és fémekre. A kémiai elemek atomjai a csillagokban keletkeznek (magfúzió), és egyik elem sem alakítható át kémiai úton egy másik elemmé. Így például nem készíthetünk aranyat valamelyik másik elemből (pl. fémből), ahogyan azt az alkímia művelői gondolták. A vegyületek többféle kémiai elem ionjaiból, atomjaiból épülnek fel. Például a konyhasó: NaCl, víz: H2O, mészkő: CaCO3, metán: CH4 .
Bár a rendszám segítségével tetszőleges elemet jelölhetünk (például 120 rendszámú elem), az újonnan felfedezett vagy még fel nem fedezett kémiai elemekre történő hivatkozások megkönnyítésére a IUPAC kidolgozta az elemek szisztematikus elnevezési rendszerét.[3] A nevet közvetlenül az elem rendszámából származtatjuk, a táblázatban szereplő számnévi gyököket használva (zárójelben a szám vegyjelben használt betűjele található). A számnévi gyökök egy része görög, más része latin eredetű, hogy ne legyenek köztük olyanok, amelyek egyforma betűvel kezdődnek. Az elem nevét úgy kapjuk, hogy a rendszám számjegyeinek sorrendjében összeolvassuk a szógyököket, és -ium végződést teszünk hozzá. Az egyszerűsítés és a jobb hangzás érdekében két kiegészítő szabály van:
A vegyjel a nevet alkotó szógyökök jeléből áll, melyeket a gyökök sorrendjében állítunk össze. A vegyjel első betűje nagybetű.
Példák:
119-es elem: un + un + enn + ium = ununennium (Uue)
123-as elem: un + bi + tr + ium = unbitrium (Ubt)
137-es elem: un + tri + szept + ium = untriszeptium (Uts)
A szisztematikus nevet csak addig lehet használni, amíg a IUPAC el nem fogadja a kémiai elem végleges nevét.
| Szám | név | jel |
| 0 | nil | n |
| 1 | un | u |
| 2 | bi | b |
| 3 | tri | t |
| 4 | kvad | q |
| 5 | pent | p |
| 6 | hex | h |
| 7 | szept | s |
| 8 | okt | o |
| 9 | enn | e |